 核磁共振波谱法
核磁共振波谱法


《核磁共振波谱法》由会员分享,可在线阅读,更多相关《核磁共振波谱法(69页珍藏版)》请在装配图网上搜索。
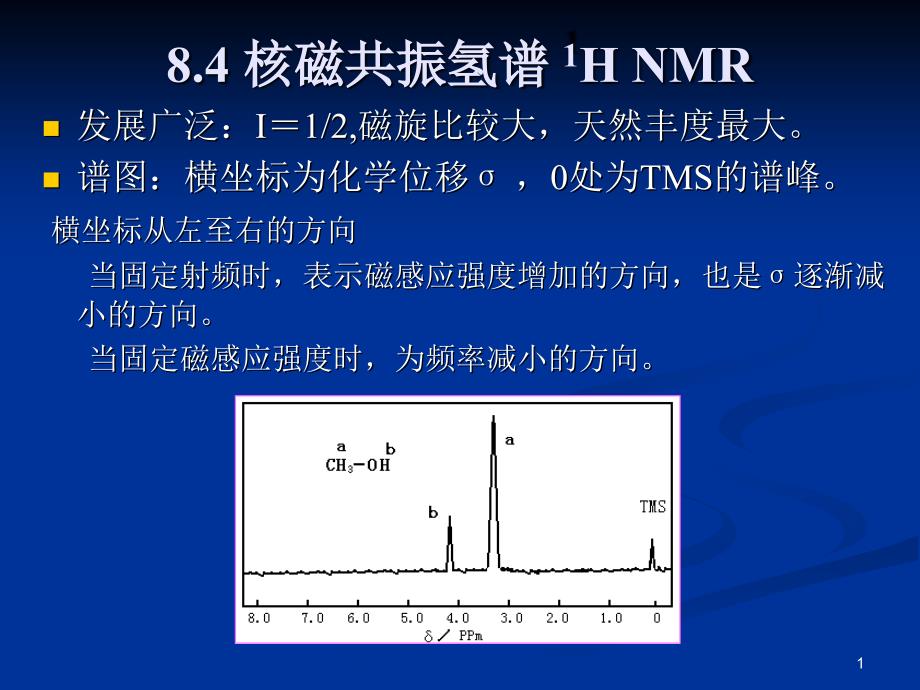
1、*,*,单击此处编辑母版标题样式,,,单击此处编辑母版文本样式,,第二级,,第三级,,第四级,,第五级,,8.4 核磁共振氢谱,1,H NMR,发展广泛:I=1/2,磁旋比较大,天然丰度最大。,,谱图:横坐标为化学位移,σ,,0处为TMS的谱峰。,,,横坐标从左至右的方向,,当固定射频时,表示磁感应强度增加的方向,也是,σ逐渐减小的方向。,,当固定磁感应强度时,为频率减小的方向。,1,,纵坐标代表谱峰的强度:积分曲线的高度与所代表的质子数成正比。,,得到信息:,,,1)吸收峰的组数说明化学环境不同。,,2)化学位移,σ说明分子中基团情况。,,3)峰的裂分情况及耦合常数,说明基团间的连接关系。,
2、,4)阶梯式积分曲线高度,说明各基团的质子比。,2,,影响化学位移的因素,化学位移可提供重要结构信息,是受氢核外电子云对核的屏蔽作用引起。 凡是使核外电子云密度改变的因素都影响化学位移。 去屏蔽作用:使氢核外电子云密度降低,谱峰位置移向低场,,,增大,(谱图左方);屏蔽作用则由于电子云密度增大使峰的位置移向高场,,,减小,(谱图的右方)。,3,,1.电负性--,去屏蔽效应,,与质子相连元素的电负性越强,吸电子作用越强,价电子偏离质子,去屏蔽作用减弱,信号峰在低场出现。,,4,,影响化学位移的因素--,磁各向异性效应,碳杂化轨道电负性:SP>SP,2,>SP,3,。,,化合物中非球形对称的电
3、子云,在外磁场作用下,会对附近的质子附加一个各向异性的磁感应场,,屏蔽增强区:与原磁场方向相反,起到屏蔽增强的作用,,σ移向高场(数值变小),,屏蔽减弱区,:,与外磁场方向相同,使外磁场强度增强,起到去屏蔽作用,,σ移向低场,数值变大。,5,,环状共轭体系: 环电流效应产生,环电流磁场,苯环上下方与原磁场磁力线方向相反:起到屏蔽增强作用,,苯环侧面,与原磁场磁力线方向相同:起到屏蔽减弱作用,,,经典例子为大环-18-环烯,,环内质子受到屏蔽作用,,σ为-1.8,外侧质子受到去屏蔽作用,σ为8.9。,6,,,双键:C=C, C=O,,碳原子的sp2杂化形成平面分子,存在环电流(相对苯环较弱)。价
4、电子产生诱导磁场,质子位于其磁力线上,与外磁场方向一致,去屏蔽。,烯氢化学位移大约5~6,,,醛基氢:去屏蔽和,,强电负性的氧原子,,σ约为9~12。,7,,,三键的磁各向异性,,,电子云成圆柱状,炔氢正好处于屏蔽区域,在高场出峰,,σ为2~3,8,,空间效应,9,,空间效应,,H,a,=3.92ppm,,H,b,=3.55ppm,,H,c,=0.88ppm,,H,a,=4.68ppm,,H,b,=2.40ppm,,H,c,=1.10ppm,去屏蔽效应,,10,,氢键效应,形成氢键后,1,H核屏蔽作用减少,氢键属于去屏蔽效应。,,使羧基质子的,σ常常超过10。,溶剂效应:同一化合物
5、在不同溶剂中,σ往往不同。,,溶剂的选择:不与溶质发生相互作用;避免溶质间的相互作用,溶液配的稀一些;避免用H,2,O作溶剂。,,用氘代氯仿作溶剂时,可加入少量氘代苯,利用氘代苯的磁各向异性时,原来相互重叠的峰组分开,。,,查阅或报道结果时须注明所用溶剂。,11,,4.,各类有机化合物的化学位移,①饱和烃,-CH,3,:,,CH3,=0.791.10ppm,,-CH,2,:,,CH2,=0.981.54ppm,,-CH:,,CH,= ,CH3,+(0.5 0.6)ppm,,H,=3.2,~4.0ppm,,,H,=2.2,~3.2ppm,,,H,=1.8,ppm,,,H,
6、=2.1,ppm,,,H,=2,~3ppm,12,,各类有机化合物的化学位移,②烯烃,,,端烯质子:,H,=4.8,~5.0ppm,,内烯质子:,H,=5.1,~5.7ppm,,与烯基,芳基共轭:,H,=4,~7ppm,③芳香烃,,,芳烃质子:,H,=6.5,~8.0ppm,,供电子基团取代-OR,-NR,2,时:,,H,=6.5,~7.0ppm,,吸电子基团取代-COCH,3,,-CN,-NO,2,时:,,H,=7.2,~8.0ppm,13,,各类有机化合物的化学位移,-COOH:,H,=10,~13ppm,-OH: (醇),H,=1.0,~6.0ppm,,,(酚),H,
7、=4,~12ppm,-NH,2,:(脂肪),H,=0.4,~3.5ppm,,,(芳香),H,=2.9,~4.8ppm,,,(酰胺),H,=9.0,~10.2ppm,-CHO:,H,=9,~10ppm,14,,常见结构单元化学位移范围,15,,一级谱图和高级谱图,磁等价,1. 化学等价(化学位移等价),,若分子中两个相同原子(或两个相同基团)处于相同的化学环境,其化学位移相同,它们是化学等价的。,化学不等价例子:,⑴ 对映异构体,,在手性溶剂中:两个CH,3,化学不等价,,在非手性溶剂中:两个CH,3,化学等价,16,,⑵ 固定在环上CH,2,的两个氢化学不等价。,⑶ 单键不能快速旋转,
8、连于同一原子上的两个相同基化学不等价。,⑷ 与手性碳相连的CH,2,的两个氢化学不等价。,17,,分子中相同种类的核(或相同基团),不仅化学位移相同,而且还以相同的偶合常数与分子中其它的核相偶合,这类核称为磁等同的核。,,注意:只有核不等价的核之间发生耦合时才产生峰的分裂。,磁等同例子:,三个H核,,化学等同,,磁等同,二个H核化学等同,磁等同,,二个F核化学等同,磁等同,六个H核,,化学等同,,磁等同,2. 磁等同,18,,两核(或基团)磁等同条件,①化学等价,(化学位移相同),,②对组外任一个核具有相同的偶合常数(数值和键数),H,a,,H,b,化学等价,磁不等同。,,J,Ha Fa,≠J
9、,Hb Fa,,F,a,,F,b,化学等价,磁不等同。,磁不同等例子:,,19,,,一、谱图中化合物的结构信息,(1)峰的数目:标志分子中磁不等性质子的种类,,多少种;,,(2)峰的强度(面积):每类质子的数目(相对),,多少个;,,(3)峰的位移(,,):,每类质子所处的化学环境,,化合物中位置;,,(4)峰的裂分数:,相邻碳原子上质子数;,,(5)偶合常数(,J,):,确定化合物构型,。,不足之处:,,仅能确定质子(氢谱)。,20,,一级谱 :可用n+1规律解释,裂分峰数符和,n,+1,规律:,,相邻的核为磁等价即只有一个偶合常数,J,,,分裂为,n+1,;若相邻,n,个核,n,1,个核
10、偶合常数为,J,1,,,n,2,个核偶合常数为,J,2,,裂分峰数为(,n,1,+1)(,n,2,+1),,2.,峰组内各裂分峰强度比,(,a,+1),n,的展开系数,,3.,从谱图中可直接读出,和,J,,,,化学位移,,在裂分峰的对称中心,裂分峰之间的距离(,Hz,),为偶合常数,J,,4.,观测不到磁等价核之间的耦合作用,,5.,在饱和化合物中间隔大于,3,个化学键的质子之间的耦合一般观测不到。,产生条件:1.相互耦合的两个核组,Δν≥10J。,,2.同一核组的核均为磁等价。,21,,高级谱(二级谱),,不能用n+1规律解释,,1.一般情况下,谱峰数目超过,n,+1规律所计算的数目,,
11、2.组内各峰之间强度关系复杂,,3.一般情况下,,和,J,不能从谱图中可直接读出:可采用计算机程序计算得到。,22,,常见复杂谱图,7,8,23,,二、简化谱图的方法,1. 采用高场强仪器:,满足,Δν≥10J,J保持不变,60,MHz,100,MHz,220,MHz,H,C,H,B,H,A,24,,2. 去偶法(双照射),以AX 系统为例:B1正常观测A,同时B2照射X使其共振饱和,从而消除了X对A的耦合作用:A由多峰变为单峰,X共振峰因饱和吸收峰消失。,,例子:教材P220,尼古丁,照射,H,a,照射,H,b,25,,核奥佛好塞效应NOE,,研究金属钠的液氨溶液当共振达到饱和时,核自旋
12、有关能级上粒子数差额增加很多,共振信号大大增强。,,发生在分子内空间位置相近的两个磁核之间,用双照射法照射其中一个使之饱和则靠近的另一个的共振信号增加。,,源于两个质子的空间位置十分接近,相互驰豫较强。,,NOE对于确定研究峰组的空间结构十分有用,是立体化学研究的重要手段。,26,,3. 位移试剂:镧系元素与,β-二酮络合物,稀土元素的离子与孤对电子配位后,,相邻,元素上质子的化学位移受位移试剂磁各各向异性影响,发生显著移动。,常用:,E,u,(DPM),3,[三—(2,,2,6,6,—四甲基)庚,二酮,—3,,5],铕,OH,OH,27,,一级谱图的解析,1.检查谱图,区别出杂质峰、溶剂峰
13、,,2.根据分子式计算化合物的,不饱和度,:环加双键数,当大于时应考虑苯环结构U=1+n,4,+(n,3,-n,1,)/2,,3.由积分曲线给出,各峰组,所对应的,原子数目,,曲线误差;分子对称使峰组数减少;,结构合理,:高场不会出现无重叠的有5或7个氢的峰组,,4. 由谱图信息推测,结构单元,,估计相邻基团,,由,σ归属种类;宽位移信号对应活泼氢;裂分情况得到邻碳的氢原子数;注意仪器工作频率从Δσ计算Δν(Hz),,5.,计算剩余,的结构单元和不饱和度,,6.根据位移和耦合关系,,组合各结构单元,得到合理的结构式,,7.对推出的结构进行指认:标准谱图。,28,,6个质子处于完全相同的化学环境
14、,单峰。,,没有直接与吸电子基团(或元素)相连,在高场出现。,1. 谱图解析(1),29,,谱图解析( 2 ),,质子a与质子b所处的化学环境不同,两个单峰。,,单峰,:没有相邻碳原子(或相邻碳原子无质子),,质子b,直接与,吸电子元素,相连,产生去屏蔽效应,,峰在低场,(相对与质子a )出现。,,质子a也受其影响,峰也向低场位移。,30,,谱图解析( 3 ),裂分与位移,31,,谱图解析( 4 ),苯环上的质子在低场出现。为什么?,,为什么1H比6H的化学位移大?,32,,结构解析:教材例8-1,,1. 分子量134;,,2. 由,σ7.0附近单峰,存在苯环结构,C,6,H,5,-,,剩余结
15、构的分子量为134-77=57,,3. 试样为烃类,由57得知剩余基团为C,4,H,9,,4.从而分子式为C,10,H,14,,不饱和度U=4,与苯环结构、分子量相符,,5.由积分曲线得5组峰对应的氢原子数,,6.化学位移、裂分情况得到片段,,7.组合得出分子结构。,33,,结构解析:教材例8-2,,1.分子式得不饱和度为3,结合2230cm,-1,,低场无吸收,排除烯烃。,,2.积分曲线结合分子式,三组峰对应2、2、3H。,,3.只有两组分裂峰,它们相互耦合(相邻),为-CH,2,CH,3,,由,σ4.2推断,-OCH,2,CH,3,;,,4.,σ3.5,单峰,,-CH2-,且为-COCH,
16、2,-,,5.已知结构有,-OCH,2,CH,3,,,-COCH,2,-,剩余CN,,结合IR知为-CN。,,6.IR 1720cm,-1,,存在酯: -CH,2,CO,-OCH,2,CH,3,,组合得到结构,34,,结构解析:教材8-3,,1. 分子量106;,σ10处窄吸收大部单峰为醛基氢1H。,,2.积分曲线,三组峰对应1H、2H和3H。,,3. 2H和3H组合为单取代苯环C6H5-,结合醛基-COH.,,没有其他片段,,,得到结构,对结构分离情况进行分析。,,35,,2. 谱图解析与结构(1)确定,5,2,2,3,化合物 C,10,H,12,O,2,8 7
17、 6 5 4 3 2 1 0,36,,谱图解析与,结构确定步骤,正确结构:,1. U,,=1+10+1/2(-12)=5,O—CH2CH2—相互偶合峰,,,3. δ,2.1单峰三个氢, —CH,3,峰,,由峰的位置结合 结构中有氧原子,可能具有:,4. δ,7.3,芳环,上氢,,单峰,烷基,单取代,δ,3.0,δ,4.30,δ,2.1,,2.,δ,3.0和,δ,4.30三重峰和三重峰,由峰裂分得知??,,峰的位置得知??,37,,谱图解析与,结构
18、(2)确定,9,δ,5.30,δ,3.38,δ,1.37,C,7,H,16,O,3,,推断其结构,6,1,38,,结构(2)确定过程,C,7,H,16,O,3,,,,,=1+7+1/2(-16)=0,a. δ,3.38和,δ,1.37 四重峰和三重峰 (只有这两组分裂峰,从而相互耦合 —CH,2,CH,3,相互偶合峰,,b. δ,3.38含有—O—CH,2,—结构,,结构中有三个氧原子,可能具有(—O—CH,2,—),3,c. δ,5.3CH上氢吸收峰,低场与电负性基团相连,正确结构:,39,,谱图解析与,结构(3),化合物 C,10,H,12,O,2,,
19、推断结构,δ7.3,δ,5.21,δ1.2,δ2.3,5H,2H,2H,3H,40,,结构(3)确定过程,化合物 C,10,H,12,O,2,,,,=1+10+1/2(-12)=5,a. δ,,2.32和,δ,1.2—CH,2,CH,3,相互偶合峰,,b. δ,7.3芳环上氢,单峰烷基单取代,,c. δ,5.21—CH,2,上氢,低场与电负性基团相连,哪个正确?,,为什么?,41,,谱图解析与,结构(4),化合物 C,8,H,8,O,2,,推断其结构,9,8,7,6,5,4,3,10,2H 2H,1H,3H,42,,结构(4)确定过程,化合物 C,8,H,8,O,2,,,=1+8+1
20、/2(-8)=5,δ,=7-8芳环上氢,四个峰对位取代,,δ δ=,9.87—,醛基上氢,,,低,δ=,3.87 CH,3,上氢,,,低场移动,与电负性强的元素相连:,—O—CH,3,正确结构:,43,,四、联合谱图解析 (1)C,6,H,12,O,,1700cm,-1,, C=0,,,醛,酮,,<3000 cm,-1,, -C-H,,饱和烃,两种质子 1:3或3:9,,-CH,3,:-C(CH,3,),3,,无裂分,无相邻质子,44,,谱图解析 (2)C,8,H,14,O,4,,1700cm,-1,, C=0,,,醛,酮,排除羧酸,醇,酚,,<3000 cm,-1,, -C-H
21、,,饱和烃,无芳环,,1.三种质子 4:4:6,,2.裂分,有相邻质子;,,3.,,,=1.3(6H) 两个 CH,3,裂分为3,相邻C有2H; CH,3,-CH,2,-,,4.,,=2.5(4H) ,单峰,,,CO-CH,2,CH,2,-CO-,,5.,,=4.1(4H) 低场(吸电子),,,两个 -O-CH,2,-,45,,8.5 核磁共振碳谱,13,C NMR,13,C谱特点:,,(1)研究C骨架,结构信息丰富;,,(2)化学位移范围大;0~250ppm;,,,可反映结构的微小变化,,(3)多种共振方法,获得不同的信息,谱图简化,13,C天然丰度低,核旋比核磁矩仅为,1,H的1/4
22、,因而信躁比仅为,1,H的1/5800.连续波模式难以实现,直到PFT-NMR的出现才得到发展。,H,0,E,I,=,I,=,,,H splitting,C,,splitting,46,,各种去偶方法,去偶的必要:,13,C-,13,C偶合的几率很小(,13,C天然丰度1.1%);,,13,C-,1,H偶合;偶合常数,1,J,CH,:100-250 Hz;峰裂分;谱图复杂;,,,(1)质子宽带去偶:,增加一高强度宽频带照射,使氢质子饱和消除,13,C-,1,H,,使碳信号为单峰。,,由于NOE效应存在,常规,13,C(去偶谱)不能直接用作定量分析,,应用:计算,13,C的种类数;确认每种,
23、13,C的化学位移值;常用来识别季碳(其峰较弱)。,,缺点:失去很多有关分子结构的信息;难以用于定量分析。,47,,质子偏共振去偶,特点:第二射频场功率较弱;偏共振频率稍高(或低)质子的共振频率。,,从而消弱了弱的耦合而使与13C直接相连的1H和13C之间留下部分耦合作用,从而既保留了碳原子级数的信息,又使谱图得到改善。,,测得的分峰数可得到与碳原子直接相连的质子数:-CH,3,四重峰,-CH,2,-三重峰,-CH-两重峰,C单峰。,48,,选择性质子去偶,,偏共振去偶的特例:调整去偶频率正好等于某种氢的共振频率,使与这种氢相连的碳原子被完全去偶。依次对,1,H进行照射,可得到相应,13,C信
24、号归属。,,各种常用的双共振见表8-6,图8-25。,49,,DEPT方法,,不失真地极化转移增强法:区别碳种类。,,对于复杂的分子,质子偏共振去偶技术仍难以满足需要,随着脉冲技术的发展,出现了多种确定碳原子级数的方法,最常用的就是DEPT.,,分为DEPT(45)、DEPT(90)、DEPT(135)三种,多数实例只记录质子宽带去偶和DEPT(135)就可以了,CH和CH3可借助化学位移来区分。,50,,碳谱与氢谱的对比谱图去偶作用对比,51,,碳谱与氢谱的对比,52,,谱图去偶作用对比,53,,谱图去偶作用对比,54,,化学位移,化学位移范围:0~250ppm;核对周围化学环境敏感,重叠少
25、,,氢谱与碳谱有较多共同点;,,碳谱化学位移规律:,,(1) 高场,低场,,碳谱:饱和烃碳原子、炔烃碳原子、烯烃碳原子、羧基碳原子,,氢谱:饱和烃氢、炔氢、烯氢、醛基氢;,,(2) 与电负性基团,化学位移向低场移动;,55,,化学位移规律:烷烃,取代烷烃:,H,3,C,C,H,2,C,H,2,C,H,2,C,H,3,3,4,.,7,2,2,.,8,1,3,.,9,碳数,n,>4 端甲基 ,C,=13-14,,,C,>,,CH,> ,CH2,>,CH3,,邻碳上取代基增多,,C,越大,56,,化学位移规律:烯烃,,C,=100-150(成对出现),端,碳,,=,CH2,,11
26、0;邻碳上取代基增多,,C,越大,:,57,,化学位移规律:,炔烃,,C,=65-90,58,,化学位移表1,chemical shift table,59,,化学位移表2,chemical shift table,60,,13C NMR 谱分析步骤,1. 鉴别谱峰,,2.分子不饱和度计算,,3.分子对称性分析,,4.由,σ区分碳原子类型:,,饱和碳原子(<100),若不连接杂原子,一般小于55;,,不饱和碳原子区(90~160)若与杂原子乡里,可大于160,,羰基或叠烯区(>150):其中酸、酯和酸酐在160~180,酮和醛大于200。,,5.碳原子级数的确定,,6.组合可能的结构式,,
27、7.指认碳谱,选出最合理结构。,61,,谱图解析:例8-4,,1.由分子式计算不饱和度为1。,,2. 谱图种类为5种,从而存在对称结构(只能为甲基);,,3.由碳的级数可知有:甲基、3个亚甲基、1个季碳,其中,σ79的季碳、 σ66的亚甲基与O相连。,,4. σ27.5对应2个甲基。,,5.无剩余结构单元,存在一环状结构。,,得到结构,62,,谱图解析:例8-5,,1. 鉴别峰形,,2.计算不饱和度为7。考虑苯环存在-C,6,H,4,-(氢谱的7.55,6.70)且为,对位双,取代类型。,,3.辐照2.67、3.85从而只有这,两个相连-CH,2,CH,2,-,。,,4.HNMR:一个甲基CH
28、,3,,,数值较大,,且为-CCH,3,;存在COH,但,数值较小,。,,5.剩余基团CN2,不饱和度为3,从而存在-CN,N。,,6.组合片段得到结构,从谱图指认,σ152,,确定结构。,63,,,13,C NMR,谱图:对称性体现,20,30,40,50,60,q,d,q,s,t,例3.化合物,C,12,H,26,,根据,13,C NMR,谱图推断其结构。,64,,四、,13,C NMR,谱图,65,,,13,C NMR,谱图2,66,,,13,C NMR,谱图4,67,,NMR于定量分析中的应用,,依据:峰组面积和引起该组峰的氢原子成正比。,,方法:图解内标法、外标法以及联立方程法,,优势:存在不重叠的谱线,灵敏度高,定量性好;借助谈普的高分辨率。,,其他应用:相对分子量测定;研究分子的内选装、测定反应速率常数、核磁成像技术;,68,,作业,,P242 8-8 8-10 8-11 8-12,69,,
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 36个关键词详解2025政府工作报告
- 学习2025年政府工作报告中的八大科技关键词
- 2025年政府工作报告要点速览接续奋斗共谱新篇
- 学习2025政府工作报告里的加减乘除
- 深化农村改革党课ppt课件(20250305)
- 弘扬雷锋精神凝聚奋进力量学习雷锋精神的丰富内涵和时代价值
- 深化农村改革推进乡村全面振兴心得体会范文(三篇)
- 2025年民营企业座谈会深度解读PPT课件
- 领导干部2024年述职述廉述责述学述法个人报告范文(四篇)
- 读懂2025中央一号党课ppt课件
- 2025年道路运输企业主要负责人安全考试练习题[含答案]
- 2024四川省雅安市中考英语真题[含答案]
- 2024湖南省中考英语真题[含答案]
- 2024宁夏中考英语真题[含答案]
- 2024四川省内江市中考英语真题[含答案]
