 高中化学 分子的立体结构2—杂化理论课件 新人教版选修3
高中化学 分子的立体结构2—杂化理论课件 新人教版选修3


《高中化学 分子的立体结构2—杂化理论课件 新人教版选修3》由会员分享,可在线阅读,更多相关《高中化学 分子的立体结构2—杂化理论课件 新人教版选修3(21页珍藏版)》请在装配图网上搜索。
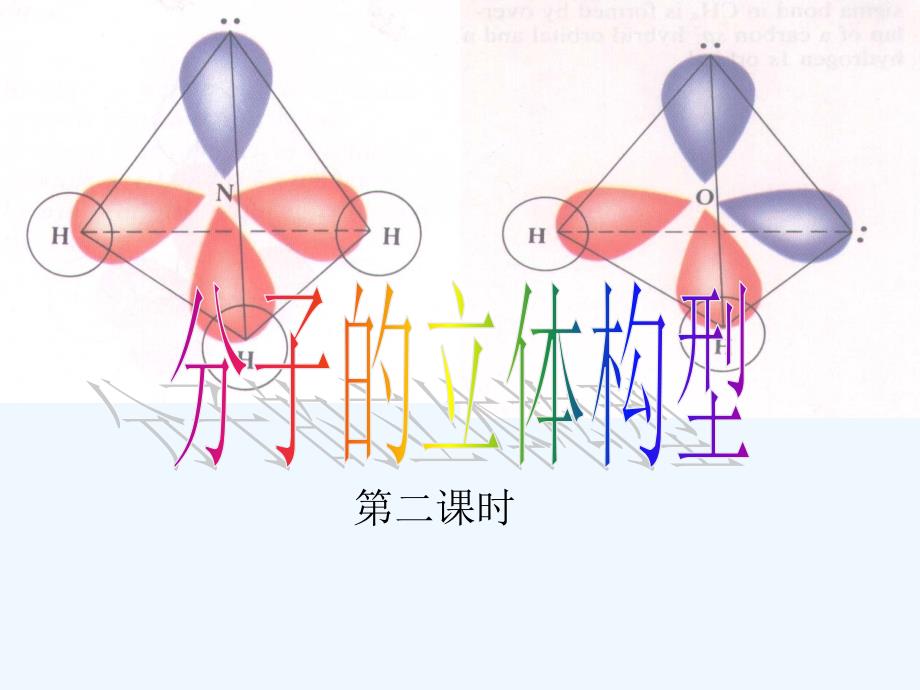
1、单击此处编辑母版标题样式,单击此处编辑母版文本样式,第二级,第三级,第四级,第五级,*,分子的立体构型,第二课时,思考,写出碳原子的核外电子排布图,思考为什么碳原子与氢原子结合形成CH,4,,而不是CH,2,?,碳原子的一个2S电子受外界影响跃迁到2P空轨道上,使碳原子具有四个单电子,,因此碳原子与氢原子结合生成CH,4,。,为了解释像甲烷等分子的立体结构,鲍林提出了杂化轨道理论。,如果C原子就以个轨道和个轨道上的单电子,分别与四个原子的轨道上的单电子重叠成键,所形成的四个共价键能否完全相同?这与CH,分子的实际情况是否吻合?,思考,看看杂化轨道理论的解释:,由1个s轨道和3个p轨道,混杂,并
2、重新组合成4个能量与形状完全相同的轨道。,我们把这种轨道称之为,sp3杂化轨道,。,4,14,为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向分别指向正四面体的四个顶点。,四个H原子分别以4个s轨道与C原子上的四个sp,3,杂化轨道相互重叠后,就形成了四个性质、能量和键角都完全相同的S-SP,3,键,从而构成一个正四面体构型的分子。,10928,sp,3,杂化,原子形成分子时,同一个原子中能量相近的一个,ns,轨道与三个,np,轨道进行混合组成四个新的原子轨道称为,sp,3,杂化轨道。,sp,3,杂化轨道特点:,四个sp,3,轨道在空间均匀分布,轨道间夹角,109.
3、5,基本要点:,在形成分子时,由于原子的相互影响,若干,不同类型能量相近的原子轨道,混合起来,重新组合成一组新轨道。这种轨道重新组合的过程叫做杂化,所形成的新轨道就称为杂化轨道。,杂化轨道,杂化前后轨道数目不变。,杂化后轨道伸展方向、形状发生改变。电子云一头大,一头小,成键时重叠程度更大。,主族元素的,ns、np轨道,BF,3,是平面三角形构型,分子中键角均为120,o,;气态BeCl,2,是直线型分子构型,分子中键角为180,o,。试用杂化轨道理论加以说明。,交流讨论,BF,3,分子的空间构型,BF,3,分子的中心原子是B,其价层电子排布为2s,2,2p,x,1,。在形成BF,3,分子的过程
4、中,B原子的2s轨道上的1个电子被激发到2p空轨道,价层电子排布为2s,1,2p,x,1,2p,y,1,,1个2s轨道和2个2p轨道进行sp,2,杂化,形成夹角均为120,0,的3个完全等同的SP,2,杂化轨道。其形成过程可表示为:,理论分析:,B原子的三个SP,2,杂化轨道分别与3个F原子含有单电子的2p轨道重叠,形成3个sp,2,-p的键。故BF,3,分子的空间构型是平面正三角形。,实验测定:,BF,3,分子中有3个完全等同的B-F键,键角为120,0,,分子的空间构型为平面正三角形。,同一个原子的一个,ns,轨道与两个,np,轨道进行杂化组合为,sp,2,杂化轨道。,sp,2,杂化轨道间
5、的夹角是120,,分子的几何构型为平面正三角形。,sp,2,杂化轨道特点:,3个sp,2,杂化轨道在一个平面内均匀分布,轨道间夹角120,sp,2,杂化,BeCl,2,分子的形成和空间构型,Be原子的价层电子排布为2s,2,。在形成BeCl,2,分子的过程中,Be原子的1个2s电子被激发到2p空轨道,价层电子排布变为为2s,1,2p,x,1,。这2个含有单电子的2s轨道和2p,x,轨道进行sp杂化,组成夹角为180,0,的2个能量相同的sp杂化轨道,其形成过程可表示为:,理论分析:,Be原子上的两个SP杂化轨道分别与2个Cl原子中含有单电子的3p轨道重叠,形成2个spp的键,所以BeCl,2,
6、分子的空间构型为直线。,实验测定:,BeCl,2,分子中有2个完全等同的BeCl键,键角为180,0,,分子的空间构型为直线。,同一原子中,ns-np,杂化成新轨道:一个,s,轨道和一个,p,轨道杂化组合成两个新的,sp,杂化轨道。,sp,杂化,sp杂化轨道特点:2个sp杂化轨道在一条直线上,轨道间夹角180,注:,杂化轨道只能用于形成,键或者用来容纳未参与成键的孤对电子;,试用杂化轨道理论分析乙烯和乙炔分子的成键情况,交流讨论,C原子在形成乙烯分子时,碳原子的2s轨道与2个2p轨道发生杂化,形成3个sp,2,杂化轨道,伸向平面正三角形的三个顶点。每个C原子的2个sp,2,杂化轨道分别与2个H
7、原子的1s轨道形成2个相同的键,各自剩余的1个sp,2,杂化轨道相互形成一个键,各自没有杂化的l个2p轨道则垂直于杂化轨道所在的平面,彼此肩并肩重叠形成键。所以,在乙烯分子中双键由一个键和一个键构成。,C原子在形成乙炔分子时发生sp杂化,两个碳原子以sp杂化轨道与氢原子的1s轨道结合形成键。各自剩余的1个sp杂化轨道相互形成1个键,两个碳原子的未杂化2p轨道分别在Y轴和Z轴方向重叠形成键。所以乙炔分子中碳原子间以叁键相结合。,杂化类型,参加杂化的轨道,杂化轨道数,分子空间构型,实 例,价层电子对数,s+p,s+(2)p,s+(3)p,2,4,3,四面体,2,3,4,sp,sp,2,sp,3,小
8、结:杂化轨道的类型与分子的空间构型,杂化轨道间的夹角,直线形,三角形,三角锥,V型,109.5,判断分子或离子中心原子的杂化类型的一般方法:,1.对于主族元素来说,中心原子的杂化轨道数=,价层电子数=,键电子对数(中心原子结合的电,子数)+孤电子对数,规律:当中心原子的价层电子对数为4时,其杂化,类型为SP,3,杂化,当中心原子的价层电子对数为3,时,其杂化类型为SP,2,杂化,当中心原子的价层电,子对数为2时,其杂化类型为SP杂化。,2.通过看中心原子有没有形成双键或三键来判断中心原子的杂化类型。,规律:如果有1个三键或两个双键,则其中有2个键,用去2个P轨道,形成的是SP杂化;如果有1个双键则其中必有1个键,用去1个P轨道,形成的是SP,2,杂化;如果全部是单键,则形成SP,3,杂化。,
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 36个关键词详解2025政府工作报告
- 学习2025年政府工作报告中的八大科技关键词
- 2025年政府工作报告要点速览接续奋斗共谱新篇
- 学习2025政府工作报告里的加减乘除
- 深化农村改革党课ppt课件(20250305)
- 弘扬雷锋精神凝聚奋进力量学习雷锋精神的丰富内涵和时代价值
- 深化农村改革推进乡村全面振兴心得体会范文(三篇)
- 2025年民营企业座谈会深度解读PPT课件
- 领导干部2024年述职述廉述责述学述法个人报告范文(四篇)
- 读懂2025中央一号党课ppt课件
- 2025年道路运输企业主要负责人安全考试练习题[含答案]
- 2024四川省雅安市中考英语真题[含答案]
- 2024湖南省中考英语真题[含答案]
- 2024宁夏中考英语真题[含答案]
- 2024四川省内江市中考英语真题[含答案]
