 大学物理第一章-温度
大学物理第一章-温度


《大学物理第一章-温度》由会员分享,可在线阅读,更多相关《大学物理第一章-温度(33页珍藏版)》请在装配图网上搜索。
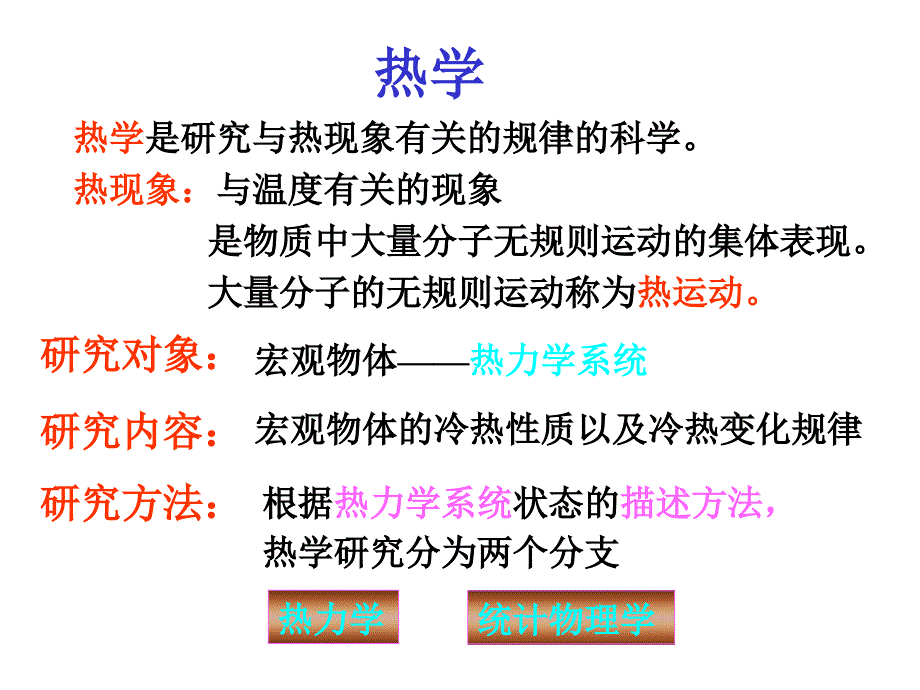
1、单击此处编辑母版标题样式,,单击此处编辑母版文本样式,,第二级,,第三级,,第四级,,第五级,,,*,热学,,热学,是研究与热现象有关的规律的科学。,,,热现象:,与温度有关的现象,,是物质中大量分子无规则运动的集体表现。,,,大量分子的无规则运动称为,热运动。,研究对象:,宏观物体——,热力学系统,研究内容:,宏观物体的冷热性质以及冷热变化规律,研究方法:,根据,热力学系统,状态的,描述方法,,,热学研究分为两个分支,热力学,统计物理学,,热力学,统计物理学,采取宏观描述方法,根据实验确定的基本规律,,,运用逻辑推理(运用数学) 来研究热力学系统的规律,,-----称为,热力学,。,,,优点
2、:可靠、普遍。 缺点:未揭示微观本质,。,采取微观描述方法,从物质的微观结构出发,,,运用统计方法来研究热力学系统的规律,,------称为,统计力学,,,,优点:揭示了热现象的微观本质。,,缺点:可靠性、普遍性差。,(其初级理论称为,气体分子运动论,),,,第一章 温度,,§1.1 宏观与微观 (,热力学系统的状态描述,),,,,一.热力学系统 二.热力学系统状态的描述,,三.平衡态 四.状态参量,,,§1.2 温度的概念,,§1.3 理想气体的温标,,§1.4 理想气体状态方程,,,一.理想气体 二
3、.理想气体状态方程,,作业:,1.5、1.7、 1.9,,,§1.1 宏观与微观,(,热力学系统的状态描述),一.热力学系统,把热学研究的对象——宏观物体称作,热力学系统,,简称,系统,特征:,由,大量,运动着的分子和原子组成,分类:,物态,热力学系统与外界关系,气体、液体、固体,以,阿佛加德罗常数,N,A,=,6. 22×10,23,计,,按热力学系统与外界关系分类,孤立系统:,封闭系统:,开放系统:,系统与外界无质量和能量交换,系统与外界无质量交换但有能量交换,系统与外界既有质量又有能量交换,外界:,热力学系统以外的物体称为外界。,例如:,汽缸内气体为系统,其它为外界,,二.热力学系统状
4、态的描述,为了研究系统的性质和变化,,,首先看看如何描述系统的状态,宏观描述方法,,用一些可以直接测量的量来描述系统的宏观性质。,,如宏观物体的,体积、压强、温度、质量,等,.,,,这些物理量称作,宏观量,,;,,,热力学采取的就是,宏观描述方法,,,,,用,宏观量,描述的热力学系统的状态称为,宏观态,.,,,微观描述方法,,给出系统中每个分子的力学物理量。,,如分子的,质量,m,、,直径,d,、,速度,v,、,,,动量,,p,、,能量,,,,等,,这些物理量称作,微观量,,一般是无法测量的。,统计物理采取的是,微观描述方法,,——用大量分子的,微观量,的集合,,来描述热力学系统的状态,,—
5、—称为,微观态,,微观量与宏观量有一定的内在联系:,,,宏观量是微观量的统计平均值,,例如:,气体的压强是大量分子撞击器壁的平均效果,,,它与大量分子对器壁的冲力的平均值有关。,一般的情况下,由于外界对系统的影响总是存在的,,,系统的状态随时间变化。,,研究一种理想状态——,平衡态,,三.平衡态,在不受外界影响的条件下,系统的宏观性质,,不随时间改变的状态,称为,平衡态,。,平衡态的定义,说明:,,“,不受外界影响,”,——,,处于平衡态的系统不与外界发生质量和能量交换,,,描述的热力学系统的状态的,宏观量,,不随时间而变化,空间上处处相同,,,平衡态只是一种宏观上的寂静状态,,,在微观上系统
6、并不是静止不变的。,,在平衡态下,组成系统的大量分子还在不停地运动着,,,这些微观运动的效果也随时间不停地急速地变化着,,,只不过大量分子总效果不随时间变化罢了。,,因此从微观统计的角度讲,平衡态应理解为,动态平衡,这里有一充满气体的箱子,箱子假想分成体积,,相同的两部分,考察两部分的,粒子数,——宏观量,如图,,达到平衡时,尽管两侧有粒子穿越虚线,,,但在宏观上可测的时间间隔内,两侧粒子数相同。,事实上不能保证任一时刻两侧粒子穿越虚线的数目,,完全相同,因此两侧粒子数不可能严格相同,,,,把这一现象称作,涨落现象,,,,平衡态时的粒子数只不过是大量分子的时间平均值,,,任一时刻粒子数与平均值
7、的差值称作,涨落,。,动态平衡,,,平衡态是一个理想化模型,,由于实际的热力学系统总要受到外界的影响,,,所以不随时间变化的平衡态是不存在的,,,平衡态是一个理想概念,,,是在一定条件下对实际情况的概括和抽象。,,在许多实际问题中,往往可以把系统的实际状态,,近似地当作平衡态来处理。,,四.状态参量,处于平衡态的系统,系统的宏观性质可以用宏观量来完全描述,,,如,体积、浓度、,,压强 、温度,等。,平衡态时,这些,宏观量,并不是独立的,,,它们之间满足一定的关系,这一关系称作,状态方程,如气体的状态方程,,根据,状态方程,,可以找到,一组独立,的宏观量,,来完全描述系统处在平衡态时的宏观性质,
8、,这样一组相互独立的,宏观量,称为,状态参量,例如,一定质量的化学纯气体处在平衡态时,,,可用气体的,压强 、温度、体积,-中任意两个量,,作为一组独立的状态参量来完全描述气体的性质。,,宏观上,描述热力学系统性质的状态参量有:,温度:,体积:,压强:,浓度:,是系统的热学参量,,T,是系统的力学参量,,P,是系统的几何参量,,V,是系统的化学参量,,n,还有其它的,其中,体积、质量,等----可以累加, 称为,广延量,。,,,压强 、温度,等----不可累加, 称为,强度量,。,,一组确定状态参量值,对应,系统一个确定的平衡态。,当选定一组独立的状态参量后,,,描述系统状态的其它宏观量就可以
9、,,表示为独立状态参量的函数,,,这些函数同系统的状态是一一对应的。,,通常称它们为,态函数,,如气体的,内能,、,熵,等,,A,B,,绝热板,A,B,,导热板,A、B 两体系互不影响,,各自达到平衡态,A、B 两体系的平衡态有联系,,达到共同的热平衡状态(,热平衡,),A,B,C,绝热板,导热板,实验规律:,如果 A 和 C、B 和 C 分别处于,,热平衡,则 A 和 B 一定热平衡。,__热力学第零定律,A、B 、C三个系统必有共同的宏观性质,,称为系统的,温度,处于热平衡的多个系统具有相同的温度,§1 .2,温度的概念,,温度测量,,A,,B,A 和 B 热平衡,,T,A,=T,B,;,
10、T,B,基本是原来体系 A 的温度,酒精或水银,热力学第零定律:,如果 A 和 C、B 和 C 分别处于热平衡,则 A 和 B 一定热平衡。,,一、,温标:,温度的数值表示法。,二、,常见的温标:,摄氏温标、理想气体温标、热力学温标,三、,理想气体温标,PV=,const.(温度不变),,,理想气体,:,严格遵守玻意耳定律的气体.,理想气体温标:,定义温度值与在该温度下一定质量的,,理想气体的PV成正比,,T,,使即,pV, T,。,玻意耳定律:,一定质量的气体,在一定温度下,其压强和,,体积的乘积是个常量.,§1 .3 理想气体的温标,,T,P,273.16 K,气相,液相,固相,临界点
11、,609Pa,水的三相点温度,:,K:温度的单位_开尔文,1954年国际上规定了标准温度定点,,----,水的三相点,.,,体积保持不变,压强保持不变,适用范围:,理想气体,四、,热力学温标(绝对温标),:,不依赖任何物质的特性,,的温标“T”,单位:开尔文(K),在理想气体温标适用范围内,理想气体温标与热力学温标是完全一致的。,热力学温度,T,与摄氏温度,t,的关系:,五、,热力学第三定律:,热力学零度是不能达到的。,t=T-273.15,实验室获得的最低温度为:2.4x10,-11,K,,一.理想气体,在任何情况下都无条件服从上述三条实验定律的气体,根据上述三条实验定律,可以导出三个状态参
12、量,,P、V、T,之间的关系——,理想气体的状态方程,处于平衡态的化学纯理想气体,,,其宏观性质可以用气体的状态参量,,,P(,压强,)、,V(,体积,)、,T(,温度,)来描述,,§1.4,理想气体状态方程,玻意尔定律(R.Boyle),盖—吕萨克定律(J.L.Gay—Lussac),查理定律(J.A.V.Charles),,二.理想气体状态方程,当质量为 ,摩尔质量为 的理想气体,,处于平衡态时,它的状态方程为,——摩尔气体常数,表示体积 中的分子总数,或,气体分子数密度,玻尔兹曼常数,,应用:,由上式,对于一定质量的气体,,,状态方程的一边为一与
13、状态参量无关的常数,,系统由一平衡态,P,1,、V,1,、T,1,经任意过程,,变化到另一平衡态,P,2,、V,2,、T,2,。,分别有:,,联立两式,此方程给出了,一定质量的气体,,,在任意两个平衡态时状态参量之间的关系.,,根据这一关系可以通过已知平衡态的状态参量,,求未知平衡态的状态参量,,例1,某种柴油机的汽缸容积为,0. 827×10,-3,m,3,设压缩前其中空气的温度是 47℃,,,压强为,8. 5×10,4,p,a,。,当活塞急剧上升时,可把空气压缩到原体积的,,1/17,,使压强增加到,4. 7×10,6,p,a,,,,求此时空气的温度(假设空气可看作理想气体),解:,空气可
14、视为理想气体,在压缩前的初状态和,,压缩后的末状态均为平衡态,,,则有,,这里,代入上式,此温度大于柴油燃点。,,例2,容器内装有氧气,质量为,0.10,,kg,,,压强为,1. 0×10,5,p,a,,,温度为 47℃。,因为容器漏气,经过若干时间后,,,压强降到原来的,5/8 ,,温度降到 27℃,,解:,氧气视为理想气体,根据理想气体的状态方程,问:容器的容积有多大?漏去了多少氧气?,,剩余氧气的质量:,漏去氧气质量:,,三.理想气体状态曲线,或,理想气体状态方程告诉理想气体处于某一平衡态时,,参量,P,、,V,、,T,之间的关系。,也告诉描述理想气体宏观性质的参量,P,、,V,、,T,
15、,只有两个是独立的,P,、,V,(或,P,、,T,或,V,、,T,,)。,,一组确定的,P,、,V,(或,P,、,T,或,V,、,T,,)数值可以,,完全表示理想气体一确定的宏观状态。,,以参量,V,为横轴,,,以,P,为纵轴,建立坐标系,,在此坐标系上任一点,,对应一组,P 、V,值,,,也对应理想气体一平衡状态。,●,设想理想气体经过一系列平衡态,,由状态,1,变化到状态,2,,,,1,●,,2,●,,由于系统在任一时刻都处于平衡态,在任一时刻系统的状态都对应于图一点; 而且理想气体的状态变化是连续,所以理想气体经过一系列平衡态由状态,1,变化到状态,2,这一过程对应于,,图一条曲线——,状态曲线,也,称作,P —V,图,●,,1,●,,2,●,,常见,状态曲线,等温线,1,3,2,1,→,2,等压线,1,→,3,等容线,2,→,3,,
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 36个关键词详解2025政府工作报告
- 学习2025年政府工作报告中的八大科技关键词
- 2025年政府工作报告要点速览接续奋斗共谱新篇
- 学习2025政府工作报告里的加减乘除
- 深化农村改革党课ppt课件(20250305)
- 弘扬雷锋精神凝聚奋进力量学习雷锋精神的丰富内涵和时代价值
- 深化农村改革推进乡村全面振兴心得体会范文(三篇)
- 2025年民营企业座谈会深度解读PPT课件
- 领导干部2024年述职述廉述责述学述法个人报告范文(四篇)
- 读懂2025中央一号党课ppt课件
- 2025年道路运输企业主要负责人安全考试练习题[含答案]
- 2024四川省雅安市中考英语真题[含答案]
- 2024湖南省中考英语真题[含答案]
- 2024宁夏中考英语真题[含答案]
- 2024四川省内江市中考英语真题[含答案]
