 物理化学电子教案—第四章
物理化学电子教案—第四章


《物理化学电子教案—第四章》由会员分享,可在线阅读,更多相关《物理化学电子教案—第四章(87页珍藏版)》请在装配图网上搜索。
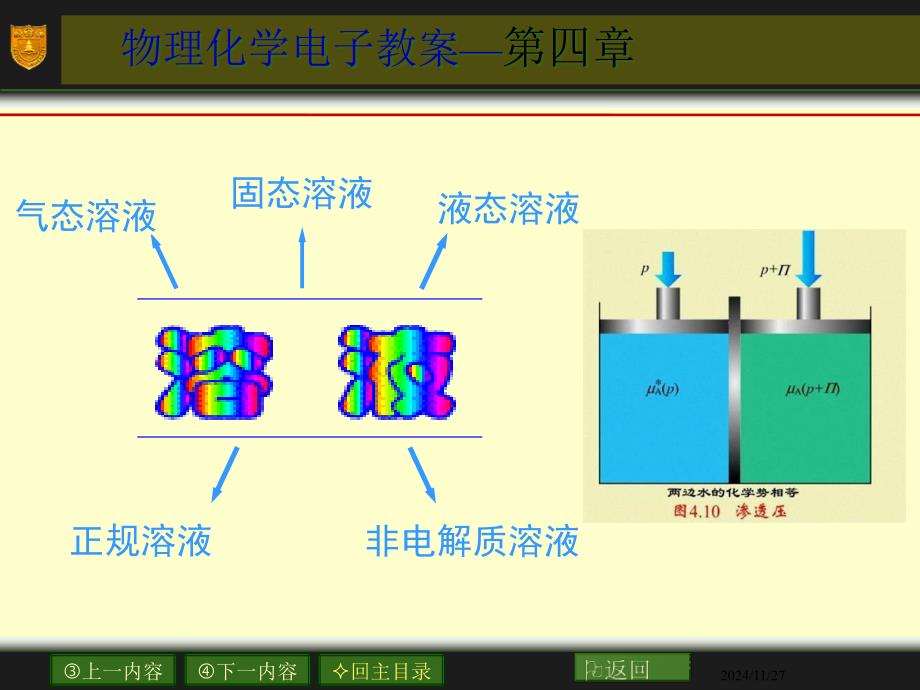
1、Click to edit Master title style,,Click to edit Master text styles,,Second level,,Third level,,Fourth level,,Fifth level,,*,,*,,,,,,单击此处编辑母版标题样式,,单击此处编辑母版文本样式,,第二级,,第三级,,第四级,,第五级,,*,上一内容,下一内容,回主目录,返回,物理化学电子教案—,第四章,,气态溶液,,固态溶液,,液态溶液,非电解质溶液,,正规溶液,,2024/11/27,第四章 溶液,4.1 引言,4.2 溶液组成的表示法,4.3 偏摩尔量
2、与化学势,4.4 稀溶液中的两个经验定律,4.5 混合气体中各组分的化学势,4.6 液体混合物,4.7 稀溶液中各组分的化学势,4.8 稀溶液的依数性,4.9,Duhem-Margules,公式,4.10 非理想溶液,4.11,,分配定律,2024/11/27,4.1,引言,溶液,(,solution),广义地说,两种或两种以上物质彼此以分子或离子状态均匀混合所形成的体系称为,溶液,。,溶液根据物态可分为,气态溶液,、,固态溶液,和,液态溶液,。根据溶液中溶质的导电性又可分为,电解质溶液,和,非电解质溶液,。,本章主要讨论液态的,非电解质溶液,。,2024/11/27,4
3、.1,引言,溶剂,(,solvent,),和溶质(,solute,),如果组成溶液的物质有不同的状态,通常将,液态物质称为溶剂,,,气态或固态物质称为溶质,。,如果都是液态,则把含量多的一种称为溶剂,含量少的称为溶质。,2024/11/27,4.1,引言,混合物(,mixture,),多组分均匀体系中,,溶剂和溶质不加区分,,各组分均可选用相同的标准态,使用相同的经验定律,这种体系称为混合物,也可分为,气态混合物、液态混合物,和,固态混合物。,2024/11/27,4.2 溶液组成的表示法,在液态的非电解质溶液中,溶质,B,的浓度表示法主要有如下四种:,1.物质的量分数,2.,质量摩尔浓度
4、,3.,物质的量浓度,4.,质量分数,2024/11/27,4.2 溶液组成的表示法,1.物质的量分数,(,mole fraction,),溶质,B,的物质的量与溶液中总的物质的量之比称为溶质,B,的物质的量分数,又称为摩尔分数,单位为,1,。,2024/11/27,4.2 溶液组成的表示法,2.,质量摩尔浓度,m,B,(,molality,),溶质,B,的物质的量与溶剂,A,的质量之比称为溶质,B,的质量摩尔浓度,单位是 。这个表示方法的优点是可以用准确的称重法来配制溶液,不受温度影响,电化学中用的很多。,2024/11/27,4.2 溶液组成的表示法,3.,物质的量浓度
5、,c,B,(,molarity,),溶质,B,的物质的量与溶液体积,V,的比值称为溶质,B,的物质的量浓度,或称为溶质,B,的浓度,单位是 ,但常用单位是 。,2024/11/27,4.2 溶液组成的表示法,4.,质量分数,w,B,(,mass fraction,),溶质,B,的质量与溶液总质量之比称为溶质,B,的质量分数,单位为,1,。,2024/11/27,4.3 偏摩尔量与化学势,单组分体系的摩尔热力学函数值,多组分体系的偏摩尔热力学函数值,化学势的定义,多组分体系中的基本公式,偏摩尔量的集合公式,Gibbs-Duhem,公式,化学势与压力的关系,化学势与温度的
6、关系,2024/11/27,单组分体系的摩尔热力学函数值,体系的状态函数中,V,U,H,S,A,G,等是广度性质,与物质的量有关。设由物质,B,组成的单组分体系的物质的量为 ,则各摩尔热力学函数值的定义式分别为:,摩尔体积(,molar volume,),摩尔热力学能(,molar thermodynamic energy,),2024/11/27,单组分体系的摩尔热力学函数值,摩尔焓(,molar enthalpy,),摩尔熵(,molar entropy,),摩尔,Helmholz,自由能(,molar Helmholz free energy,),摩尔,Gibbs,,自由能(,mola
7、r Gibbs free energy,),这些摩尔热力学函数值都是强度性质。,2024/11/27,多组分体系的偏摩尔热力学函数值,在多组分体系中,每个热力学函数的变量就不止两个,还与组成体系各物的物质的量有关。设,Z,代表,V,U,H,S,A,G,等广度性质,则对多组分体系,偏摩尔量,Z,B,的定义为:,,Z,B,称为物质,B,的某种容量性质,Z,的,偏摩尔量,(,partial molar quantity,)。,2024/11/27,多组分体系的偏摩尔热力学函数值,使用偏摩尔量时应注意:,1.,偏摩尔量的含义是:在等温、等压、保持,B,物质以外的所有组分的物质的量不变的条件下,改变 所
8、引起广度性质,Z,的变化值,或在等温、等压条件下,在大量的定组成体系中加入单位物质的量的,B,物质所引起广度性质,Z,的变化值。,2.,只有广度性质才有偏摩尔量,而偏摩尔量是强度性质。,3.,纯物质的偏摩尔量就是它的摩尔量。,4.,任何偏摩尔量都是,T,p,和,组成的函数。,2024/11/27,偏摩尔量的集合公式,设一个均相体系由,1、2、 、,k,个组分组成,则体系任一容量性质,Z,应是,T,p,及各组分物质的量的函数,即:,在等温、等压条件下:,2024/11/27,偏摩尔量的集合公式,按偏摩尔量定义,,在保持偏摩尔量不变的情况下,对上式积分,则,2024/11/27,偏摩尔量的集合
9、公式,这就是偏摩尔量的集合公式,说明体系的总的容量性质等于各组分偏摩尔量的加和。,例如:体系只有两个组分,其物质的量和偏摩尔体积分别为,,和 ,则体系的总体积为:,2024/11/27,偏摩尔量的集合公式,写成一般式有:,2024/11/27,Gibbs-Duhem,公式,如果在溶液中不按比例地添加各组分,则溶液浓度会发生改变,这时各组分的物质的量和偏摩尔量均会改变。,对,Z,进行微分,根据集合公式,在等温、等压下某均相体系任一容量性质的全微分为:,2024/11/27,Gibbs-Duhem,公式,这就称为,Gibbs-Duhem,公式,说明偏摩尔量之间是具有一定联系的。某一偏摩尔量
10、的变化可从其它偏摩尔量的变化中求得。,(1)(2)两式相比,得:,2024/11/27,化学势的定义,广义定义:,保持特征变量和除,B,以外其它组分不变,某热力学函数随其物质的量 的变化率称为化学势。,2024/11/27,化学势的定义,狭义定义:,保持温度、压力和除,B,以外的其它组分不变,体系的,Gibbs,自由能随 的变化率称为化学势,,所以化学势就是偏摩尔,Gibbs,自由能。,化学势在判断相变和化学变化的方向和限度方面有重要作用。,2024/11/27,多组分体系中的基本公式,在多组分体系中,热力学函数的值不仅与其特征变量有关,还与组成体系的各组分的物质的量有关。,例如:热力学
11、能,其全微分,同理:,即:,2024/11/27,化学势与压力的关系,对于纯组分体系,根据基本公式,有:,对多组分体系,把 换为 ,则摩尔体积变为偏摩尔体积 。,2024/11/27,化学势与温度的关系,根据纯组分的基本公式,,将 代替 ,则得到的摩尔体积 换为偏摩尔体积 。,2024/11/27,4.4 稀溶液中的两个经验定律,拉乌尔,定律,(,Raoult’s Law,),1887,年,法国化学家,Raoult,从实验中归纳出一个经验定律:,在定温下,在稀溶液中,溶剂的蒸气压等于纯溶剂蒸气压 乘以溶液中溶剂的物质的量分数,,用公式表示为:,如果溶液中只有,A
12、,B,两个组分,则,拉乌尔定律也可表示为:,溶剂蒸气压的降低值与纯溶剂蒸气压之比等于溶质的摩尔分数。,2024/11/27,4.4 稀溶液中的两个经验定律,亨利,定律(,Henry’s Law,),1803,年英国化学家,Henry,根据实验总结出另一条经验定律:,在一定温度和平衡状态下,气体在液体里的溶解度(用物质的量分数,x,表示)与该气体的平衡分压,p,成正比。,用公式表示为:,或,式中 称为亨利定律常数,其数值与温度、压力、溶剂和溶质的性质有关。若浓度的表示方法不同,则其值亦不等,即:,2024/11/27,4.4 稀溶液中的两个经验定律,使用亨利定律应注意:,(1),式中,
13、p,为该气体的分压。对于混合气体,在总压不大时,亨利定律分别适用于每一种气体。,(3),溶液浓度愈稀,对亨利定律符合得愈好。对气体溶质,升高温度或降低压力,降低了溶解度,能更好服从亨利定律。,(2),溶质在气相和在溶液中的分子状态必须相同。,如 ,在气相为 分子,在液相为 和 ,则亨利定律不适用。,2024/11/27,4.5 混合气体中各组分的化学势,理想气体的化学势,气相混合物中各组分的化学势,*,非理想气体的化学势,2024/11/27,理想气体的化学势,只有一种理想气体,,2024/11/27,理想气体的化学势,这是理想气体化学势的表达式。化学势是,T,,,p,的函
14、数。 是温度为,T,,,压力为标准压力时理想气体的化学势,这个状态就是,气体的标准态,。,2024/11/27,气体混合物中各组分的化学势,气体混合物中某一种气体,B,的化学势,这个式子也可看作理想气体混合物的定义。,将道尔顿分压定律 代入上式,得:,是纯气体,B,在指定,T,p,时的化学势,显然这不是标准态。,2024/11/27,*,非理想气体的化学势,设非理想气体的状态方程可用,Kamerling-Onnes,公式表示,,为积分常数,从边界条件求得。当,p,很小时,,(,A),当 时,即为理想气体,(,B),比较(,A)、(B),两式,得:,2024/11/27,*,非理想
15、气体的化学势,将 代入非理想气体化学势表示式,得:,令,则,f,,称为逸度(,fugacity,),,可看作是有效压力。,,,称为逸度系数(,fugacity coefficient,),当 ,就是理想气体。,显然,实际气体的状态方程不同,逸度系数也不同。可以用(,1,)图解法(,2),对比状态法或,(3),近似法求逸度系数。,2024/11/27,4.6 液体混合物,液体混合物以前称为理想溶液。,液体混合物定义:,不分溶剂和溶质,,任一组分在全部浓度范围内都符合拉乌尔定律,;从分子模型上看,各组分分子彼此相似,在混合时没有热效应和体积变化,这种溶液称为液体
16、混合物。光学异构体、同位素和立体异构体混合物属于这种类型。,液体混合物通性:,(1),(2),(3),(4),(5),拉乌尔定律和亨利定律没有区别,2024/11/27,4.6 液体混合物,(1),式中 不是标准态化学势,而是在温度,T,,,液面上总压,p,时纯,B,的化学势。考虑到压力对化学势的影响,用,(2),式表示,,(2),式中 是标准态化学势。,由于液体体积受压力影响较小,通常忽略积分项,得:,这就是液体混合物中任一组分化学势的表示式,也可以作为液体混合物的热力学定义:即任一组分的化学势可以用该式表示的溶液称为液体混合物。,液体混合物中各组分的化学势,或,(1),(
17、2),2024/11/27,4.7,稀溶液中各组分的化学势,稀溶液的定义,溶剂的化学势,溶质的化学势,2024/11/27,4.7,稀溶液中各组分的化学势,两种挥发性物质组成一溶液,在一定的温度和压力下,在一定的浓度范围内,,溶剂遵守,Raoult,定律,溶质遵守,Henry,定律,这种溶液称为稀溶液,。值得注意的是,化学热力学中的稀溶液并不仅仅是指浓度很小的溶液。,稀溶液的定义,2024/11/27,4.7,稀溶液中各组分的化学势,溶剂服从,Raoult,定律, 是在该温度下纯溶剂的饱和蒸气压。,的物理意义是:等温、等压时,纯溶剂,,的化学势,它不是标准态。,溶剂的化学势,202
18、4/11/27,溶质的化学势,Henry,定律因浓度表示方法不同,有如下三种形式:,溶质实际的蒸气压曲线如实线所示,,W,点是 时的蒸气压。,是 时又服从,Henry,定律,那个假想态的化学势,实际不存在,,如图中的,R,点。利用这个参考态,在求,或 时,可以消去,不影响计算。,2024/11/27,溶质的化学势,2024/11/27,溶质的化学势,(2)当 时,同理:,是 时,又服从,Henry,定律那个假想态的化学势。,2024/11/27,溶质的化学势,2024/11/27,溶质的化学势,(3)当 时,是 时又服从,,Henry,定律那个假想态的化学势
19、,,2024/11/27,溶质的化学势,2024/11/27,4.8 稀溶液的依数性,依数性质:(,colligative properties,),指定溶剂的类型和数量后,这些,性质只取决于所含溶质粒子的数目,,而与溶质的本性无关。溶质的粒子可以是分子、离子、大分子或胶粒,这里只讨论粒子是分子的情况,其余在下册讨论。,依数性的种类:,1.,蒸气压下降,2.,凝固点降低,3.,沸点升高,4.,渗透压,2024/11/27,对于二组分稀溶液,加入非挥发性溶质,B,以后,溶剂,A,的蒸气压会下降。,这是造成凝固点下降、沸点升高和渗透压的根本原因。,蒸气压下降,蒸气压下降,2024/11/27
20、,称为凝固点降低系数(,freezing point lowering coefficients,),,单位,为,非电解质溶质的质量摩尔浓度,单位:,这里的凝固点是指纯溶剂固体析出时的温度。,常用溶剂的 值有表可查。用实验测定 值,查出,,就可计算溶质的摩尔质量。,凝固点降低,凝固点降低,2024/11/27,称为沸点升高系数(,boiling point elevation coefficints,),,单位 。常用溶剂的 值有表可查。,测定 值,查出 ,就可以计算溶质的摩尔质量。,沸点升高,沸点升高,2024/11/27,如图所示,在半透膜左边放溶剂,右边放
21、溶液。只有溶剂能透过半透膜。由于纯溶剂的化学势 大于溶液中溶剂的化学势 ,所以溶剂有自左向右渗透的倾向。,为了阻止溶剂渗透,在右边施加额外压力,使半透膜双方溶剂的化学势相等而达到平衡。,这个额外施加的压力就定义为渗透压,。,,是溶质的浓度。浓度不能太大,这公式就是适用于稀溶液的,van’t Hoff,,公式。,渗透压(,osmotic pressure,),渗透压(,osmotic pressure,),2024/11/27,渗透压(,osmotic pressure,),2024/11/27,4.9,Duhem-Margules,,公式,Gibbs-Duhem,公式,我们已知,Gibb
22、s-Duhem,公式,它指出溶液中各偏摩尔量之间是有相互关系的,即:,例如,对于只含,A,和,B,的二组分体系,它们的偏摩尔体积间有如下关系:,可以从一种偏摩尔量的变化求出另一偏摩尔量的变化值。,2024/11/27,4.9,Duhem-Margules,,公式,它是,Gibbs-Duhem,公式的延伸,主要讨论二组分体系中各组分蒸气压与组成之间的关系,,Duhem-Margules,公式可表示为:,Duhem-Margules,,公式,2024/11/27,4.9.,Duhem-Margules,,公式,从,Duhem-Margules,公式可知:,(1)在某一浓度区间,若,A,遵守,Rao
23、ult,定律,则另一,组分,B,必遵守,Henry,定律,这与实验事实相符。,(2)在溶液中,某一组分的浓度增加后,它在气相,中的分压上升,则另一组分在气相中的分压必然下降。,(3)可以求得总蒸气压与组成的关系,见柯诺瓦洛夫,规则。,2024/11/27,4.9,Duhem-Margules,,公式,,,根据,Gibbs-Duhem,公式并进行数学处理得到:,设组分,A,在液相和气相中的摩尔分数分别为,和 , 则:,柯诺瓦洛夫规则,2024/11/27,4.9,Duhem-Margules,,公式,,,如果 ,这是在总压-组成图(即 图)上,相当于曲线的最高或最低点,
24、这时 ,即气液两相组成相同(是恒沸混合物),,这称为柯诺瓦洛夫第一规则。,(1)柯诺瓦洛夫第一规则,2024/11/27,4.9,Duhem-Margules,,公式,,,若 ,则 ,也就是气相中,A,组分的摩尔分数增加使总蒸气压也增加,则气相中的,A,浓度大于液相中的,A,浓度。同理,若 ,则 。这称为,柯诺瓦洛夫第二规则 。,(2)柯诺瓦洛夫第二规则,2024/11/27,渗透系数,4.10 非理想溶液,活度的概念,溶质,B,的化学势,超额函数,无热溶液,正规溶液,2024/11/27,路易斯(,G.N.Lewis,),提出了活度的
25、概念。,4.10 非理想溶液,在非理想溶液中,拉乌尔定律应修正为:,相对活度的定义:,活度的概念,2024/11/27,4.10 非理想溶液,称为相对活度,,,是量纲为,1,的量。 称为活度因子(,activity factor,),,表示实际溶液与理想溶液的偏差,量纲为,1,。,显然,这是浓度用 表示的活度和活度因子,若浓度用 表示,则对应有 和 ,显然它们彼此不相等。,2024/11/27,4.10 非理想溶液,非理想溶液中组分,B,的化学势表示式,由于浓度的表示式不同,化学势表示式也略有差异。,(1),浓度用摩尔分数 表
26、示,是在,T,,,p,时,当 那个假想状态的化学势。因为在 从,0 — 1,的范围内不可能始终服从,Henry,定律,这个状态实际上不存在,但不影响 的计算。,溶质,B,的化学势,2024/11/27,4.10 非理想溶液,(2),浓度用质量摩尔浓度 表示,是在,T,,,p,时,当 时仍服从,Henry,定律那个假想状态的化学势, 。,2024/11/27,4.10 非理想溶液,(3) 浓度用物质的量浓度 表示,是在,T,,,p,时,当 时假想状态的化学势, 。,显然 ,但,B,物质的化学
27、势 是相同的,并不因为浓度的表示方法不同而有所不同。,2024/11/27,渗透系数(,osmotic coefficient),溶液中溶剂占多数,如果也用活度因子 来表示,偏差不明显,所以,Bjerrum,建议用渗透系数 来表示溶剂的非理想程度。,渗透系数的定义:,2024/11/27,渗透系数(,osmotic coefficient),以(1)式为例:,因为:,比较两式得,例如,,298,K,时, 的,KCl,水溶液中, ,这数值很不显著。而 ,就显著地看出溶剂水的非理想程度。,2024/11/27,超额函数(,excess functio
28、n,),用,活度因子,表示,溶质,的非理想程度,用,渗透系数,可以较显著地表示,溶剂,的非理想程度,而,超额函数,用来较方便地表示整个,溶液,的非理想程度。,将组分,1,和组分,2以,物质的量 和 混合,若溶液是理想的,则:,2024/11/27,超额函数(,excess function,),如果溶液是非理想的,则变化值都不为零,但热力学函数之间的基本关系仍然存在。,(1)超额吉布斯自由能,超额吉布斯自由能表示实际混合过程中的 与理想混合时 的差值。,2024/11/27,超额函数(,excess function,),2024/11/27,超额函数(,excess functio
29、n,),加和项中包含了溶质和溶剂的活度因子,可以衡量整个溶液的不理想程度。,当 ,表示体系对理想情况发生正偏差;,当 ,则发生负偏差。,2024/11/27,超额函数(,excess function,),(2)超额体积,2024/11/27,超额函数(,excess function,),(3)超额焓,根据,Gibbs-Helmhotz,方程,2024/11/27,超额函数(,excess function,),(4)超额熵,2024/11/27,正规溶液(,regular solution,),根据热力学函数间的关系,,当 或 ,则 ,这时,溶液的非理想性完全由
30、混合热效应引起,,这种非理想溶液称为,正规溶液,。,2024/11/27,正规溶液(,regular solution,),所以,在正规溶液中,因为 ,所以:,因为,2024/11/27,正规溶液(,regular solution,),正规溶液中,各组分活度系数的对数与,T,成反比。,代入上式,得:,2024/11/27,无热溶液(,athermal solution,),如果 ,或 ,则 ,这种,溶液的非理想性完全由熵效应引起,的,所以称为,无热溶液,。,2024/11/27,无热溶液(,athermal solution,),因为 ,所以,
31、所以在无热溶液中,各组分的活度系数均与,T,无关。,2024/11/27,4.11,分配定律,“在定温、定压下,若一个物质溶解在两个同时存在的互不相溶的液体里,达到平衡后,该物质在两相中浓度之比等于常数” ,这称为分配定律。用公式表示为:,式中 和 分别为溶质,B,在两个互不相溶的溶剂 中的浓度,,K,称为分配系数(,distribution coefficient,)。,2024/11/27,分配定律,当溶液浓度不大时,活度比可用浓度比代替,就得到分配定律的经验式。,这个经验定律可以从热力学得到证明。定温定压下,达到平衡时,溶质,B,在 两相中的化学势相等,
32、即:,影响,K,值的因素有温度、压力、溶质及两种溶剂的性质,在溶液浓度不太大时能很好地与实验结果相符。,2024/11/27,4.11 分配定律,如果溶质在任一溶剂中有缔合或离解现象,则分配定律只能适用于在溶剂中分子形态相同的部分。,分配定律的应用:,(1)可以计算萃取的效率问题。例如,使某一定量溶液中溶质降到某一程度,需用一定体积的萃取剂萃取多少次才能达到。,(2)可以证明,当萃取剂数量有限时,分若干次萃取的效率要比一次萃取的高。,2024/11/27,FRANCOLS-MARIE RAOULT,FRANCOLS-MARIE RAOULT,(1830-1901),French chemis
33、t, was a pioneer in solution chemistry. His work on vapor-pressure lowering and on freezing-point depressions was fundamentally important in the chemistry of solutions,and his fealization that both were a function of the number of moles of dissolved solute contributed greatly to the determination of
34、 molar masses and the theory of ionic solutions.,2024/11/27,FRANCOLS-MARIE RAOULT,His contributions to cryoscopy, or freezing-point depressions, were prodigious,and Victor Meyer used his data as early as 1886 for determining molar masses. Raoult built for these measurements what he called a cryoscop
35、e of precision, and the accuracy of his work was unsurpassed, agreeing in many instances with modern measurements within 0.0001,℃,.,2024/11/27,FRANCOLS-MARIE RAOULT,His thermometer was considered by some to be antediluvian, but as van’t Hoff expressed it, “With this antediluvian thermometer the worl
36、d was conquered.”,2024/11/27,WILLIAM HENRY,WILLIAM HENRY,(1775-1836),was an English chemist, textbook writer, and translator of Lavoisier. While he was engaged in experiments of the amount of gas absorbed by water, he discovered what is now known as Henry’s law; the amount of gas absorbed is direct
37、ly proportional to the pressure. Henry committed suicide in a fit of melancholia.,2024/11/27,,谢谢观看,/,欢迎下载,BY FAITH I MEAN A VISION OF GOOD ONE CHERISHES AND THE ENTHUSIASM THAT PUSHES ONE TO SEEK ITS FULFILLMENT REGARDLESS OF OBSTACLES. BY FAITH I BY FAITH,内容总结,物理化学电子教案—第四章。广义地说,两种或两种以上物质彼此以分子或离子状态均
38、匀混合所形成的体系称为溶液。在液态的非电解质溶液中,溶质B的浓度表示法主要有如下四种:。2.只有广度性质才有偏摩尔量,而偏摩尔量是强度性质。3.纯物质的偏摩尔量就是它的摩尔量。化学势在判断相变和化学变化的方向和限度方面有重要作用。1803年英国化学家Henry根据实验总结出另一条经验定律:在一定温度和平衡状态下,气体在液体里的溶解度(用物质的量分数x表示)与该气体的平衡分压p成正比。(2)溶质在气相和在溶液中的分子状态必须相同。气体混合物中某一种气体B的化学势。(5)拉乌尔定律和亨利定律没有区别。(2)当 时,同理:。这里的凝固点是指纯溶剂固体析出时的温度。我们已知Gibbs-Duhem公式,它指出溶液中各偏摩尔量之间是有相互关系的,即:。路易斯(G.N.Lewis)提出了活度的概念。谢谢观看/欢迎下载,
- 温馨提示:
1: 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
2: 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
3.本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
5. 装配图网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025年水电工程运行维护管理合同示范文本.docx
- 2025年工程勘测设计合同模板.docx
- 2025年区域产品销售代理合同.docx
- 2025年经销商授权合同样本.docx
- 2025年员工住房资金借贷合同.docx
- 2025年轻钢建筑施工合同示例.docx
- 2025年网络推广托管合同.docx
- 2025年简明个人借款正式合同范例.docx
- 2025年房产按揭贷款合同范例.docx
- 2025年技术合同争议调解.docx
- 2025年电子版城市住宅租赁合同范本.docx
- 2025年简易转让合同协议书样本.docx
- 2025年投资顾问服务合同实例.docx
- 2025年经销合同模板.docx
- 2025年工业项目设计合同样本.docx
